- BIOMIMÉTIQUE (CHIMIE)
- BIOMIMÉTIQUE (CHIMIE)Les processus enzymatiques, et d’une manière générale les réactions chimiques qui interviennent dans la nature, constituent depuis longtemps pour les chimistes organiciens à la fois un modèle et une source d’inspiration. La chimie «biomimétique» a pour objectif de transposer à la chimie organique l’efficacité des réactions enzymatiques. Elle peut procéder selon deux démarches différentes:– soit en produisant des réactions par associations spécifiques de réactifs, en vue de conduire à une augmentation de la vitesse mais surtout de la sélectivité de ces réactions;– soit en reproduisant, avec les méthodes de la chimie organique classique, une étape clé de l’élaboration des molécules selon un mécanisme similaire à celui qui intervient réellement (biosynthèse) ou qui est supposé intervenir dans la nature (biogenèse).Ces deux démarches sont différentes par leurs champs d’applications.Synthèses biomimétiques par association spécifique des réactifsLes enzymes, comparées aux catalyseurs utilisés en chimie organique ou minérale, se caractérisent par une plus grande efficacité (augmentation de la vitesse des réactions), et surtout par une sélectivité remarquable: sur un substrat complexe, présentant de nombreux groupes fonctionnels, une enzyme donnée pourra catalyser une seule des multiples réactions possibles et permettra donc à cette réaction, et à elle seule, de s’effectuer à une vitesse appréciable.On admet que la catalyse enzymatique s’effectue par association spécifique du substrat S avec l’enzyme E au sein d’un complexe enzyme-substrat E-S dont l’évolution conduit au produit P et régénère l’enzyme E:
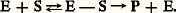 C’est précisément cette association qui explique la grande spécificité des réactions enzymatiques: la géométrie du complexe E-S, et donc le rapprochement dans l’espace de certains groupes fonctionnels, va conduire à la formation privilégiée du produit P résultant de l’interaction de ces groupes fonctionnels.Or, une des préoccupations majeures de la chimie organique de synthèse est précisément d’augmenter la sélectivité des réactions, de façon à n’obtenir, sinon exclusivement, du moins en proportion majoritaire, que le produit désiré; dans la synthèse de produits à activité pharmacologique en particulier, la sélectivité de la réaction est souvent primordiale, et elle peut être obtenue, avec plus ou moins de succès bien sûr, par l’utilisation de réactifs très élaborés et de conditions réactionnelles très strictes (les solvants, la température, etc.).Depuis 1970 a été développée une méthodologie biomimétique qui cherche à augmenter la sélectivité de la réaction entre deux composés A et B par association spécifique préalable de A et B: l’idée fondamentale est d’orienter la réaction ultérieure par un choix judicieux de la géométrie de l’intermédiaire A-B qui va ainsi «mimer» le complexe enzyme-substrat E-S des réactions enzymatiques:
C’est précisément cette association qui explique la grande spécificité des réactions enzymatiques: la géométrie du complexe E-S, et donc le rapprochement dans l’espace de certains groupes fonctionnels, va conduire à la formation privilégiée du produit P résultant de l’interaction de ces groupes fonctionnels.Or, une des préoccupations majeures de la chimie organique de synthèse est précisément d’augmenter la sélectivité des réactions, de façon à n’obtenir, sinon exclusivement, du moins en proportion majoritaire, que le produit désiré; dans la synthèse de produits à activité pharmacologique en particulier, la sélectivité de la réaction est souvent primordiale, et elle peut être obtenue, avec plus ou moins de succès bien sûr, par l’utilisation de réactifs très élaborés et de conditions réactionnelles très strictes (les solvants, la température, etc.).Depuis 1970 a été développée une méthodologie biomimétique qui cherche à augmenter la sélectivité de la réaction entre deux composés A et B par association spécifique préalable de A et B: l’idée fondamentale est d’orienter la réaction ultérieure par un choix judicieux de la géométrie de l’intermédiaire A-B qui va ainsi «mimer» le complexe enzyme-substrat E-S des réactions enzymatiques: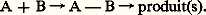 La géométrie du composé intermédiaire A-B devra être assez rigide pour obtenir une bonne sélectivité de réaction: il faudra donc que l’association entre A et B soit assez forte; mais il faudra également que cette liaison soit chimiquement labile pour permettre l’isolement du (ou des) produit(s) de la réaction.Une liaison covalente a surtout été utilisée: liaison ester , très forte mais facilement rompue, après réaction, par hydrolyse ou saponification. D’autres types de liaisons, de plus faible énergie que la liaison covalente, ont également été utilisés, mais en général avec une moindre efficacité: coordination autour d’un métal, liaison hydrogène, interactions électrostatiques, interactions hydrophobes et composés d’inclusions.Les résultats les plus nets ont été obtenus lors de la réaction d’un substrat stéroïde rigide, tel le cholestanol, avec un réactif pouvant rompre une liaison 令 C 漣 H en donnant le radical 令 C size=1鍊 qui va alors évoluer en conduisant, par exemple, à la formation d’une double liaison:
La géométrie du composé intermédiaire A-B devra être assez rigide pour obtenir une bonne sélectivité de réaction: il faudra donc que l’association entre A et B soit assez forte; mais il faudra également que cette liaison soit chimiquement labile pour permettre l’isolement du (ou des) produit(s) de la réaction.Une liaison covalente a surtout été utilisée: liaison ester , très forte mais facilement rompue, après réaction, par hydrolyse ou saponification. D’autres types de liaisons, de plus faible énergie que la liaison covalente, ont également été utilisés, mais en général avec une moindre efficacité: coordination autour d’un métal, liaison hydrogène, interactions électrostatiques, interactions hydrophobes et composés d’inclusions.Les résultats les plus nets ont été obtenus lors de la réaction d’un substrat stéroïde rigide, tel le cholestanol, avec un réactif pouvant rompre une liaison 令 C 漣 H en donnant le radical 令 C size=1鍊 qui va alors évoluer en conduisant, par exemple, à la formation d’une double liaison: avec un des carbones voisins; ce type de réaction revient donc à fonctionnaliser l’atome de carbone C 漣 H, car la double liaison pourra ensuite être transformée en d’autres fonctions, par application de méthodes classiques de chimie organique. De très bons résultats ont été obtenus en utilisant des réactifs du type benzophénone (type 1, fig. 1) ou du type dichloro-iodo-benzène (type 2, fig. 1), ces composés étant liés au cholestanol par une fonction ester au niveau de la fonction OH du stéroïde.Pour le réactif de type 1, on aboutit à la structure ester, dérivé du cholestanol et d’un homologue de la benzophénone (type a) pour le composé «intermédiaire» (fig. 1). Par irradiation photochimique de ce dernier, certaines liaisons C 漣 H, les liaisons axiales, perpendiculaires au plan moyen du cholestanol, en position 見 (situées en dessous de ce plan moyen), et dont l’atome de carbone est tertiaire, c’est-à-dire lié à un seul atome d’hydrogène, vont pouvoir être rompues et finalement conduire à des doubles liaisons. L’examen des modèles moléculaires, correspondant aux composés de type a, montre que la nature et le nombre des liaisons rompues, à savoir l’orientation et la sélectivité de la réaction, vont dépendre de la valeur de n dans le groupement polyméthylénique (CH2)n dans les composés de type a. Cela est confirmé par les résultats expérimentaux suivants: pour n = 1, on obtient uniquement, avec un rendement de 55 p. 100, le dérivé éthylénique (type b) qui correspond à la rupture de la liaison C 漣 H en position 14 (fig. 1); pour n = 2, ce même composé est également obtenu seul avec un rendement de 35 p. 100; par contre, pour n = 4, on obtient les composés correspondant chacun à la rupture de la liaison portée par le carbone en position 14 (30 p. 100) et 16 (25 p. 100).L’utilisation de réactifs du type 2 liés au cholestanol a également été très fructueuse: en faisant varier la géométrie du réactif accroché en position 3 du cholestanol, il a été possible de fonctionnaliser le carbone 9 ou le carbone 14 du stéroïde. La fonctionnalisation du carbone 9 permet d’accéder aux corticostéroïdes (anti-inflammatoires) et à d’autres stéroïdes d’intérêt thérapeutique; habituellement, l’industrie pharmaceutique obtient les corticostéroïdes par fermentations microbiologiques: un processus chimique biomimétique s’est donc révélé capable d’effectuer une réaction pour laquelle il fallait auparavant s’adresser aux micro-organismes et à leurs systèmes enzymatiques. Une nouvelle et intéressante synthèse de la cortisone a pu ainsi être proposée. À partir d’autres réactifs du type 2, on a pu, par des processus semblables, couper la chaîne latérale fixée au stéroïde par le carbone 17, et ainsi accéder à la série de l’androstérone, hormone sexuelle importante. Une telle dégradation est habituellement effectuée par une suite de réactions chimiques et microbiologiques dans lesquelles les systèmes enzymatiques assurent la sélectivité des transformations.Si dans les réactions précédentes le stéroïde rigide est remplacé par un substrat flexible (une chaîne aliphatique), la sélectivité de la réaction est alors fortement diminuée: la géométrie plus lâche du composé intermédiaire conduit alors à un grand nombre de produits de réactions. De même, si l’association spécifique entre les réactifs est assurée par des liaisons de plus faible énergie que la liaison covalente, la sélectivité obtenue est en général plus faible, mais certaines perspectives sont très intéressantes. Ainsi, la cyclodextrine, sucre à structure cyclique soluble dans l’eau, présente dans sa forme spatiale une cavité hydrophobe cylindrique: l’anisole, également hydrophobe, a tendance à former dans l’eau avec la cyclodextrine un complexe stable en occupant la cavité hydrophobe de cette dernière, ses dimensions le lui permettant. Lorsque l’anisole réagit avec l’acide hypochloreux en présence de cyclodextrine, on obtient une plus forte proportion de para-chloroanisole: cela est interprété par une structure particulière du complexe anisole-cyclodextrine, dans laquelle la position ortho- de l’anisole est «enfouie» dans la cavité de la cyclodextrine et ainsi protégée de l’approche du réactif (fig. 2 a).Des réactions biomimétiques effectuées à l’état solide ont été décrites. Ainsi, l’acide désoxycholique donne, à l’état solide, des composés d’inclusion bien définis avec un certain nombre de composés organiques, tels le percarbonate de t -butyle et l’acétone (fig. 2 b). Par réaction photochimique ou radicalaire de ces composés d’inclusion, il a été possible de fonctionnaliser spécifiquement l’acide désoxycholique par réaction avec le composé organique inclus. La structure des composés d’inclusion a été déterminée par diffraction des rayons X. On a observé que l’association spécifique entre le réactif et le substrat, dans ces réactions à l’état solide, résulte de l’orientation bien définie de l’acide désoxycholique et du composé inclus, ainsi que de la distance entre le site de fonctionnalisation de cet acide et le groupement fonctionnel du composé, ce qui conduit à une réaction sélective.Synthèses biomimétiques de produits naturelsLa biosynthèse de nombreux composés naturels étant connue, au moins dans ses grandes lignes, la nature suggère aux chimistes organiciens des schémas ou des étapes de synthèse particulièrement intéressants. En effet, les organismes vivants font appel à des réactions simples à haut rendement, demandant le minimum d’énergie et stéréospécifiques, c’est-à-dire conduisant à un seul isomère. La biosynthèse d’un produit naturel P est réalisée dans la nature à partir d’un précurseur simple p (par exemple, l’acide acétique, sous forme d’acétyl-coenzyme A) qui, par une suite de réactions réalisées par des enzymes spécifiques E1, E2, E3 ... En est transformé en composés intermédiaires I1, I2, I3 ... In , pour aboutir finalement à P:
avec un des carbones voisins; ce type de réaction revient donc à fonctionnaliser l’atome de carbone C 漣 H, car la double liaison pourra ensuite être transformée en d’autres fonctions, par application de méthodes classiques de chimie organique. De très bons résultats ont été obtenus en utilisant des réactifs du type benzophénone (type 1, fig. 1) ou du type dichloro-iodo-benzène (type 2, fig. 1), ces composés étant liés au cholestanol par une fonction ester au niveau de la fonction OH du stéroïde.Pour le réactif de type 1, on aboutit à la structure ester, dérivé du cholestanol et d’un homologue de la benzophénone (type a) pour le composé «intermédiaire» (fig. 1). Par irradiation photochimique de ce dernier, certaines liaisons C 漣 H, les liaisons axiales, perpendiculaires au plan moyen du cholestanol, en position 見 (situées en dessous de ce plan moyen), et dont l’atome de carbone est tertiaire, c’est-à-dire lié à un seul atome d’hydrogène, vont pouvoir être rompues et finalement conduire à des doubles liaisons. L’examen des modèles moléculaires, correspondant aux composés de type a, montre que la nature et le nombre des liaisons rompues, à savoir l’orientation et la sélectivité de la réaction, vont dépendre de la valeur de n dans le groupement polyméthylénique (CH2)n dans les composés de type a. Cela est confirmé par les résultats expérimentaux suivants: pour n = 1, on obtient uniquement, avec un rendement de 55 p. 100, le dérivé éthylénique (type b) qui correspond à la rupture de la liaison C 漣 H en position 14 (fig. 1); pour n = 2, ce même composé est également obtenu seul avec un rendement de 35 p. 100; par contre, pour n = 4, on obtient les composés correspondant chacun à la rupture de la liaison portée par le carbone en position 14 (30 p. 100) et 16 (25 p. 100).L’utilisation de réactifs du type 2 liés au cholestanol a également été très fructueuse: en faisant varier la géométrie du réactif accroché en position 3 du cholestanol, il a été possible de fonctionnaliser le carbone 9 ou le carbone 14 du stéroïde. La fonctionnalisation du carbone 9 permet d’accéder aux corticostéroïdes (anti-inflammatoires) et à d’autres stéroïdes d’intérêt thérapeutique; habituellement, l’industrie pharmaceutique obtient les corticostéroïdes par fermentations microbiologiques: un processus chimique biomimétique s’est donc révélé capable d’effectuer une réaction pour laquelle il fallait auparavant s’adresser aux micro-organismes et à leurs systèmes enzymatiques. Une nouvelle et intéressante synthèse de la cortisone a pu ainsi être proposée. À partir d’autres réactifs du type 2, on a pu, par des processus semblables, couper la chaîne latérale fixée au stéroïde par le carbone 17, et ainsi accéder à la série de l’androstérone, hormone sexuelle importante. Une telle dégradation est habituellement effectuée par une suite de réactions chimiques et microbiologiques dans lesquelles les systèmes enzymatiques assurent la sélectivité des transformations.Si dans les réactions précédentes le stéroïde rigide est remplacé par un substrat flexible (une chaîne aliphatique), la sélectivité de la réaction est alors fortement diminuée: la géométrie plus lâche du composé intermédiaire conduit alors à un grand nombre de produits de réactions. De même, si l’association spécifique entre les réactifs est assurée par des liaisons de plus faible énergie que la liaison covalente, la sélectivité obtenue est en général plus faible, mais certaines perspectives sont très intéressantes. Ainsi, la cyclodextrine, sucre à structure cyclique soluble dans l’eau, présente dans sa forme spatiale une cavité hydrophobe cylindrique: l’anisole, également hydrophobe, a tendance à former dans l’eau avec la cyclodextrine un complexe stable en occupant la cavité hydrophobe de cette dernière, ses dimensions le lui permettant. Lorsque l’anisole réagit avec l’acide hypochloreux en présence de cyclodextrine, on obtient une plus forte proportion de para-chloroanisole: cela est interprété par une structure particulière du complexe anisole-cyclodextrine, dans laquelle la position ortho- de l’anisole est «enfouie» dans la cavité de la cyclodextrine et ainsi protégée de l’approche du réactif (fig. 2 a).Des réactions biomimétiques effectuées à l’état solide ont été décrites. Ainsi, l’acide désoxycholique donne, à l’état solide, des composés d’inclusion bien définis avec un certain nombre de composés organiques, tels le percarbonate de t -butyle et l’acétone (fig. 2 b). Par réaction photochimique ou radicalaire de ces composés d’inclusion, il a été possible de fonctionnaliser spécifiquement l’acide désoxycholique par réaction avec le composé organique inclus. La structure des composés d’inclusion a été déterminée par diffraction des rayons X. On a observé que l’association spécifique entre le réactif et le substrat, dans ces réactions à l’état solide, résulte de l’orientation bien définie de l’acide désoxycholique et du composé inclus, ainsi que de la distance entre le site de fonctionnalisation de cet acide et le groupement fonctionnel du composé, ce qui conduit à une réaction sélective.Synthèses biomimétiques de produits naturelsLa biosynthèse de nombreux composés naturels étant connue, au moins dans ses grandes lignes, la nature suggère aux chimistes organiciens des schémas ou des étapes de synthèse particulièrement intéressants. En effet, les organismes vivants font appel à des réactions simples à haut rendement, demandant le minimum d’énergie et stéréospécifiques, c’est-à-dire conduisant à un seul isomère. La biosynthèse d’un produit naturel P est réalisée dans la nature à partir d’un précurseur simple p (par exemple, l’acide acétique, sous forme d’acétyl-coenzyme A) qui, par une suite de réactions réalisées par des enzymes spécifiques E1, E2, E3 ... En est transformé en composés intermédiaires I1, I2, I3 ... In , pour aboutir finalement à P: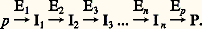 Le chimiste organicien ne peut cependant pas réaliser une suite de réactions enzymatiques complexes comme le fait la nature; il devra préparer, par les méthodes classiques de la chimie organique, un des intermédiaires I1, I2, I3... In de la biosynthèse et le soumettre à une réaction chimique, équivalente à celle que réalise l’enzyme E1, E2, E3 ... E n , E p , qui conduira à l’intermédiaire suivant I2, I3... I n ou au produit naturel lui-même P, ou à un de ses dérivés immédiats. Ce type de synthèse est biomimétique car une étape (I2I3 ou I nP, par exemple) est inspirée directement du processus naturel ou biosynthèse.Dans les cas où l’on obtient des intermédiaires, ceux-ci pourront ensuite être transformés par d’autres réactions biomimétiques ou par des réactions de chimie organique classique, pour aboutir finalement au produit naturel P.Cette approche s’oppose aux synthèses classiques qui aboutissent au produit naturel sans jamais passer par un intermédiaire de la biosynthèse.La difficulté réside plus dans l’élaboration de l’intermédiaire clé que dans la réaction biomimétique; cependant, l’obtention d’un seul isomère parmi les nombreux possibles constitue un tel avantage que cette voie peut être considérée comme la plus logique et la plus simple pour la synthèse totale de produits naturels complexes, ceux qui ont un intérêt thérapeutique, en particulier.Une majorité de médicaments sont d’origine naturelle ou ont une structure inspirée d’un modèle naturel: d’où l’intérêt de la chimie biomimétique pour leur synthèse qui peut être réalisée à partir de composés chimiques peu élaborés (synthèse totale) ou à partir de produits naturels intermédiaires situés en amont dans les étapes de la biosynthèse (hémisynthèse).Les hormones stéroïdiques appartiennent, avec leurs dérivés synthétiques ou hémisynthétiques, à un domaine thérapeutique important (anticonceptionnels, anti-inflammatoires, thérapeutique des troubles hormonaux, etc.).La transformation de stéroïdes d’origine végétale ou animale représente encore une source pour la préparation des produits utilisés en thérapeutique (hémisynthèse); cependant, la synthèse totale entre pour une part importante dans la fabrication de certains dérivés. Ces synthèses s’effectuent classiquement par une succession de cyclisation étape par étape, pour conduire aux molécules stéroïdiques comprenant quatre cycles.Il est connu que la biosynthèse des stérols, précurseurs des hormones stéroïdiques, est réalisée par une cyclisation enzymatique en une seule étape de l’époxyde de squalène (fig. 3 a). Cette réaction induite par la fonction époxyde est stéréospécifique, c’est-à-dire qu’elle ne conduit qu’à un seul stérol, le lanostérol ultérieurement transformé, entre autres, en une hormone telle que la progestérone (fig. 3 a).Les réactions biomimétiques réalisées sur des dérivés du squalène lui-même ayant donné des résultats décevants, des molécules équivalentes ont été recherchées. Ainsi, d’autres fonctions telles que les acétals ou les alcools allyliques peuvent jouer le rôle de la fonction époxyde dans l’induction de la réaction de cyclisation de molécules insaturées, polyènes analogues du squalène (fig. 3 b).Ainsi, un polyène considéré comme équivalent de l’époxyde de squalène conduit après cyclisation au dérivé tétracyclique, finalement transformé par des réactions chimiques classiques en hydroxy-11 見 progestérone (fig. 3 b). La réaction chimique, qui permet de passer du polyène au dérivé tétracyclique, est biomimétique, car elle mime dans son mécanisme de cyclisation ce qui existe dans la nature pour le passage de l’époxyde de squalène au lanostérol.Il faut également remarquer que le polyène étant optiquement actif, l’hydroxy-11 見 progestérone est obtenue sous sa forme naturelle, c’est-à-dire sous la forme d’un seul isomère optique. Cela est particulièrement important pour les synthèses de produits à activité biologique dont les propriétés sont le plus souvent liées à un seul isomère.Les antibiotiques sont essentiellement produits par des fermentations microbiologiques dont l’efficacité est difficile à égaler par les réactions chimiques classiques. Cependant, si cette méthode est capable de fournir des produits relativement bon marché, elle ne conduit pas à une grande variété structurale dans chaque classe.La recherche de transformations chimiques ou de synthèses d’analogues structuraux dans la série des antibiotiques est nécessaire pour trouver de nouvelles substances actives contre les germes qui deviennent résistants. La synthèse biomimétique est l’une des voies possibles dans ce domaine où la recherche pharmaceutique est très active.Les tétracyclines sont des antibiotiques synthétisés par les micro-organismes à partir de l’acétyl-coenzyme A qui est condensé en un intermédiaire poly- 廓 cétonique (type 1). La cyclisation de ce dernier en tétracyclines est l’étape importante de cette biosynthèse (fig. 4 a). Une synthèse biomimétique consistera donc à préparer un composé poly- 廓 cétonique de ce type et à le transformer en dérivé polycyclique par une réaction chimique équivalente à celle qui se passe dans la nature.Seule une molécule tricyclique a pu être préparée par voie biomimétique à partir du dérivé poly- 廓 cétonique (type 2), lui-même synthétisé de manière classique à partir d’un diester (fig. 4 b). La difficulté pour réaliser cette synthèse tient dans la préparation des dérivés poly- 廓 cétoniques de type 1 ou 2 et dans les réactions de cyclisation qui sont vraisemblablement contrôlées dans la nature par chélation avec certains ions métalliques, conditions qui n’ont pu être encore bien reproduites au laboratoire.Les pénicillines et les céphalosporines sont des antibiotiques 廓-lactamiques (cycle azoté à quatre éléments) biosynthétisés à partir d’un tripeptide non cyclisé qui conduit d’abord à la pénicilline N par double cyclisation. Un réarrangement avec agrandissement du cycle à cinq éléments en un cycle à six éléments mène finalement à la desacétoxy-céphalosporine C (fig. 5, voie a puis b). Plusieurs synthèses élégantes de ce groupe d’antibiotiques ont été réalisées, une seule fait appel à une conception biomimétique; un dérivé de la déhydrovaline équivalent du tripeptide naturel a été synthétisé et soumis à une suite de réactions biomimétiques qui ont alors permis d’accéder aux séries de la pénicilline et de la céphalosporine avec de bons rendements (fig. 5, voie c ou d).La transformation d’un produit abondant, la pénicilline, en un autre antibiotique plus rare, la desacétoxy-céphalosporine (fig. 5, voie b) est une opération réalisée industriellement.Cette réaction effectuée par l’intermédiaire du sulfoxyde de pénicilline est probablement biomimétique, mais la démonstration n’en a pas encore été faite. Ce résultat montre la fécondité de la chimie biomimétique qui peut prendre pour base l’imitation d’une réaction connue de la biosynthèse ou bien une réaction hypothétique non encore prouvée. La chimie biomimétique peut ainsi aider à la compréhension d’une étape de la biosynthèse qui est d’autant plus vraisemblable qu’elle a son équivalent chimique au laboratoire.Les alcaloïdes représentent un des groupes les plus importants parmi les produits naturels, près de 6 000 dérivés ont été décrits. Depuis les temps les plus anciens, ils ont été utilisés, sous forme d’extraits de plantes, comme médicaments, poisons ou «potions magiques». Ce n’est qu’au siècle dernier que les principes actifs ont été isolés: morphine (pavot), nicotine (tabac), quinine (quinquina), etc. Il a fallu attendre la seconde moitié du XXe siècle pour que la synthèse des plus compliqués d’entre eux soit réalisée. La pharmacopée actuelle compte un bon nombre d’alcaloïdes parmi les médicaments les plus actifs qui sont soit encore extraits à partir de sources végétales, soit synthétisés ou hémisynthétisés lorsque l’approvisionnement naturel est insuffisant. Les alcaloïdes se prêtent bien à la chimie biomimétique pour différentes raisons. D’abord leurs précurseurs, dérivés des acides aminés, sont en général facilement accessibles, contrairement à ce qui se passe pour les autres composés précités; ensuite il n’est pas rare de pouvoir isoler des intermédiaires stables de la biosynthèse qui peuvent servir de matière première pour la synthèse de produits naturels plus rares situés en aval dans la biosynthèse.La vinblastine et la vincristine (fig. 6) sont des alcaloïdes antimitotiques utilisés dans la chimiothérapie du cancer. Ce sont des dimères formés par la réunion de deux alcaloïdes monomères isolés de la même plante. Malheureusement, la faible teneur de la plante en alcaloïdes rend ces médicaments très coûteux; c’est la raison pour laquelle de nombreux efforts ont été faits pour les synthétiser. Les deux alcaloïdes monomères réunis dans les dimères sont la vindoline et un dérivé de la catharanthine (fig. 6). Le problème de la biogenèse de ces dimères, c’est-à-dire la manière dont les deux moitiés peuvent réagir l’une sur l’autre pour se coupler, est longtemps resté sans réponse. C’est la raison pour laquelle aucune réaction de couplage biomimétique des deux monomères ne pouvait être tentée. Les premiers essais de synthèse chimique classique consistaient à condenser la vindoline avec une catharanthine fragmentée (la liaison C(16) – C(21) étant rompue) telle qu’elle existe dans les dimères. Ces synthèses conduisent à des dimères épimères en C(16), des produits naturels et dépourvus d’activité antitumorale.Il est finalement apparu comme vraisemblable que, dans la nature, la vindoline devait réagir sur un dérivé non fragmenté de la catharanthine et que la fragmentation de la molécule devait résulter de la réaction de couplage des deux molécules. Cette hypothèse s’est révélée fructueuse puisque la vindoline et le N-oxyde de catharanthine se couplent bien, au cours d’une réaction de Polonovski modifiée, pour donner les dimères naturels. L’obtention, pour la première fois, des dimères avec la bonne configuration en C(16 ) signifie probablement que cette réaction mime bien leur biosynthèse. La réaction de Polonovski modifiée (action de l’anhydride trifluoroacétique sur un N-oxyde) représente un excellent modèle chimique d’une réaction biologique générale des amines tertiaires ou de leurs N-oxydes; on peut donc la considérer comme une réaction biomimétique. De nombreux autres exemples dans la chimie des alcaloïdes démontrent ce fait.La morphine , extraite du pavot, est connue depuis le XIXe siècle; sa structure a été déterminée en 1925 et la première synthèse totale a été finalement réussie en 1952. Ce n’est qu’en 1957 qu’une hypothèse a été faite pour expliquer sa biosynthèse à partir de radicaux phénoliques dérivés de la (face=F0019 size=1梁)N-éthoxycarbonyl-norréticuline, dont le couplage permet de créer la liaison carbone-carbone nécessaire à l’élaboration du précurseur immédiat de la morphine (fig. 7).Une synthèse biomimétique rentable de la morphine n’a été réalisée qu’en 1975. Pour cela il était nécessaire, comme le fait la nature, de créer sélectivement, à partir de la (face=F0019 size=1梁)N-éthoxycarbonyl-norréticuline, les radicaux en position ortho- et para- des fonctions phénols. Ce n’est qu’après de longues recherches que le réactif approprié, le tristrifluoroacétate de thallium (TTFA) a pu être trouvé. Le traitement de la ( size=1梁)N-éthoxycarbonyl-norréticuline par un équivalent de TTFA, dans le chlorure de méthylène à 漣 78 0C conduit, selon une réaction biomimétique, à un dérivé qui peut être ensuite transformé en morphine par des réactions classiques (fig. 7). Cet exemple montre qu’il est quelquefois difficile de trouver le réactif chimique équivalent du système enzymatique.La vincamine , alcaloïde indolique extrait de la petite pervenche, est largement utilisée en thérapeutique pour les troubles de la circulation cérébrale liés à la sénescence. L’insuffisance de l’approvisionnement à partir des sources naturelles a conduit à la mise au point d’une synthèse partielle biomimétique à partir d’un autre alcaloïde plus abondant, la tabersonine (fig. 8). La tabersonine et la vincamine appartiennent au même type biogénétique, la tabersonine étant un intermédiaire en amont de la vincamine dans la suite de la biosynthèse. L’avantage de cette hémisynthèse, à haut rendement, est de faire appel à une matière première naturelle de même configuration absolue, ce qui élimine le problème de la séparation des isomères optiques, nécessaire dans la synthèse classique.Ainsi, les synthèses biomimétiques sont choisies pour l’intérêt qu’elles présentent, en particulier pour la préparation de produits biologiquement actifs.Le plus souvent, les premières synthèses avaient été réalisées de manière classique, soit parce que la biosynthèse n’était pas encore connue, soit parce que la synthèse biomimétique présentait certaines difficultés pour la préparation de l’intermédiaire clé ou pour la recherche du bon réactif.Si seules quelques synthèses biomimétiques sont utilisées industriellement, on observe de nombreux efforts des chimistes organiciens pour réaliser de nouvelles synthèses ou des transformations selon un mode biomimétique, dans le but d’aboutir à des procédés plus simples, donc plus économiques.
Le chimiste organicien ne peut cependant pas réaliser une suite de réactions enzymatiques complexes comme le fait la nature; il devra préparer, par les méthodes classiques de la chimie organique, un des intermédiaires I1, I2, I3... In de la biosynthèse et le soumettre à une réaction chimique, équivalente à celle que réalise l’enzyme E1, E2, E3 ... E n , E p , qui conduira à l’intermédiaire suivant I2, I3... I n ou au produit naturel lui-même P, ou à un de ses dérivés immédiats. Ce type de synthèse est biomimétique car une étape (I2I3 ou I nP, par exemple) est inspirée directement du processus naturel ou biosynthèse.Dans les cas où l’on obtient des intermédiaires, ceux-ci pourront ensuite être transformés par d’autres réactions biomimétiques ou par des réactions de chimie organique classique, pour aboutir finalement au produit naturel P.Cette approche s’oppose aux synthèses classiques qui aboutissent au produit naturel sans jamais passer par un intermédiaire de la biosynthèse.La difficulté réside plus dans l’élaboration de l’intermédiaire clé que dans la réaction biomimétique; cependant, l’obtention d’un seul isomère parmi les nombreux possibles constitue un tel avantage que cette voie peut être considérée comme la plus logique et la plus simple pour la synthèse totale de produits naturels complexes, ceux qui ont un intérêt thérapeutique, en particulier.Une majorité de médicaments sont d’origine naturelle ou ont une structure inspirée d’un modèle naturel: d’où l’intérêt de la chimie biomimétique pour leur synthèse qui peut être réalisée à partir de composés chimiques peu élaborés (synthèse totale) ou à partir de produits naturels intermédiaires situés en amont dans les étapes de la biosynthèse (hémisynthèse).Les hormones stéroïdiques appartiennent, avec leurs dérivés synthétiques ou hémisynthétiques, à un domaine thérapeutique important (anticonceptionnels, anti-inflammatoires, thérapeutique des troubles hormonaux, etc.).La transformation de stéroïdes d’origine végétale ou animale représente encore une source pour la préparation des produits utilisés en thérapeutique (hémisynthèse); cependant, la synthèse totale entre pour une part importante dans la fabrication de certains dérivés. Ces synthèses s’effectuent classiquement par une succession de cyclisation étape par étape, pour conduire aux molécules stéroïdiques comprenant quatre cycles.Il est connu que la biosynthèse des stérols, précurseurs des hormones stéroïdiques, est réalisée par une cyclisation enzymatique en une seule étape de l’époxyde de squalène (fig. 3 a). Cette réaction induite par la fonction époxyde est stéréospécifique, c’est-à-dire qu’elle ne conduit qu’à un seul stérol, le lanostérol ultérieurement transformé, entre autres, en une hormone telle que la progestérone (fig. 3 a).Les réactions biomimétiques réalisées sur des dérivés du squalène lui-même ayant donné des résultats décevants, des molécules équivalentes ont été recherchées. Ainsi, d’autres fonctions telles que les acétals ou les alcools allyliques peuvent jouer le rôle de la fonction époxyde dans l’induction de la réaction de cyclisation de molécules insaturées, polyènes analogues du squalène (fig. 3 b).Ainsi, un polyène considéré comme équivalent de l’époxyde de squalène conduit après cyclisation au dérivé tétracyclique, finalement transformé par des réactions chimiques classiques en hydroxy-11 見 progestérone (fig. 3 b). La réaction chimique, qui permet de passer du polyène au dérivé tétracyclique, est biomimétique, car elle mime dans son mécanisme de cyclisation ce qui existe dans la nature pour le passage de l’époxyde de squalène au lanostérol.Il faut également remarquer que le polyène étant optiquement actif, l’hydroxy-11 見 progestérone est obtenue sous sa forme naturelle, c’est-à-dire sous la forme d’un seul isomère optique. Cela est particulièrement important pour les synthèses de produits à activité biologique dont les propriétés sont le plus souvent liées à un seul isomère.Les antibiotiques sont essentiellement produits par des fermentations microbiologiques dont l’efficacité est difficile à égaler par les réactions chimiques classiques. Cependant, si cette méthode est capable de fournir des produits relativement bon marché, elle ne conduit pas à une grande variété structurale dans chaque classe.La recherche de transformations chimiques ou de synthèses d’analogues structuraux dans la série des antibiotiques est nécessaire pour trouver de nouvelles substances actives contre les germes qui deviennent résistants. La synthèse biomimétique est l’une des voies possibles dans ce domaine où la recherche pharmaceutique est très active.Les tétracyclines sont des antibiotiques synthétisés par les micro-organismes à partir de l’acétyl-coenzyme A qui est condensé en un intermédiaire poly- 廓 cétonique (type 1). La cyclisation de ce dernier en tétracyclines est l’étape importante de cette biosynthèse (fig. 4 a). Une synthèse biomimétique consistera donc à préparer un composé poly- 廓 cétonique de ce type et à le transformer en dérivé polycyclique par une réaction chimique équivalente à celle qui se passe dans la nature.Seule une molécule tricyclique a pu être préparée par voie biomimétique à partir du dérivé poly- 廓 cétonique (type 2), lui-même synthétisé de manière classique à partir d’un diester (fig. 4 b). La difficulté pour réaliser cette synthèse tient dans la préparation des dérivés poly- 廓 cétoniques de type 1 ou 2 et dans les réactions de cyclisation qui sont vraisemblablement contrôlées dans la nature par chélation avec certains ions métalliques, conditions qui n’ont pu être encore bien reproduites au laboratoire.Les pénicillines et les céphalosporines sont des antibiotiques 廓-lactamiques (cycle azoté à quatre éléments) biosynthétisés à partir d’un tripeptide non cyclisé qui conduit d’abord à la pénicilline N par double cyclisation. Un réarrangement avec agrandissement du cycle à cinq éléments en un cycle à six éléments mène finalement à la desacétoxy-céphalosporine C (fig. 5, voie a puis b). Plusieurs synthèses élégantes de ce groupe d’antibiotiques ont été réalisées, une seule fait appel à une conception biomimétique; un dérivé de la déhydrovaline équivalent du tripeptide naturel a été synthétisé et soumis à une suite de réactions biomimétiques qui ont alors permis d’accéder aux séries de la pénicilline et de la céphalosporine avec de bons rendements (fig. 5, voie c ou d).La transformation d’un produit abondant, la pénicilline, en un autre antibiotique plus rare, la desacétoxy-céphalosporine (fig. 5, voie b) est une opération réalisée industriellement.Cette réaction effectuée par l’intermédiaire du sulfoxyde de pénicilline est probablement biomimétique, mais la démonstration n’en a pas encore été faite. Ce résultat montre la fécondité de la chimie biomimétique qui peut prendre pour base l’imitation d’une réaction connue de la biosynthèse ou bien une réaction hypothétique non encore prouvée. La chimie biomimétique peut ainsi aider à la compréhension d’une étape de la biosynthèse qui est d’autant plus vraisemblable qu’elle a son équivalent chimique au laboratoire.Les alcaloïdes représentent un des groupes les plus importants parmi les produits naturels, près de 6 000 dérivés ont été décrits. Depuis les temps les plus anciens, ils ont été utilisés, sous forme d’extraits de plantes, comme médicaments, poisons ou «potions magiques». Ce n’est qu’au siècle dernier que les principes actifs ont été isolés: morphine (pavot), nicotine (tabac), quinine (quinquina), etc. Il a fallu attendre la seconde moitié du XXe siècle pour que la synthèse des plus compliqués d’entre eux soit réalisée. La pharmacopée actuelle compte un bon nombre d’alcaloïdes parmi les médicaments les plus actifs qui sont soit encore extraits à partir de sources végétales, soit synthétisés ou hémisynthétisés lorsque l’approvisionnement naturel est insuffisant. Les alcaloïdes se prêtent bien à la chimie biomimétique pour différentes raisons. D’abord leurs précurseurs, dérivés des acides aminés, sont en général facilement accessibles, contrairement à ce qui se passe pour les autres composés précités; ensuite il n’est pas rare de pouvoir isoler des intermédiaires stables de la biosynthèse qui peuvent servir de matière première pour la synthèse de produits naturels plus rares situés en aval dans la biosynthèse.La vinblastine et la vincristine (fig. 6) sont des alcaloïdes antimitotiques utilisés dans la chimiothérapie du cancer. Ce sont des dimères formés par la réunion de deux alcaloïdes monomères isolés de la même plante. Malheureusement, la faible teneur de la plante en alcaloïdes rend ces médicaments très coûteux; c’est la raison pour laquelle de nombreux efforts ont été faits pour les synthétiser. Les deux alcaloïdes monomères réunis dans les dimères sont la vindoline et un dérivé de la catharanthine (fig. 6). Le problème de la biogenèse de ces dimères, c’est-à-dire la manière dont les deux moitiés peuvent réagir l’une sur l’autre pour se coupler, est longtemps resté sans réponse. C’est la raison pour laquelle aucune réaction de couplage biomimétique des deux monomères ne pouvait être tentée. Les premiers essais de synthèse chimique classique consistaient à condenser la vindoline avec une catharanthine fragmentée (la liaison C(16) – C(21) étant rompue) telle qu’elle existe dans les dimères. Ces synthèses conduisent à des dimères épimères en C(16), des produits naturels et dépourvus d’activité antitumorale.Il est finalement apparu comme vraisemblable que, dans la nature, la vindoline devait réagir sur un dérivé non fragmenté de la catharanthine et que la fragmentation de la molécule devait résulter de la réaction de couplage des deux molécules. Cette hypothèse s’est révélée fructueuse puisque la vindoline et le N-oxyde de catharanthine se couplent bien, au cours d’une réaction de Polonovski modifiée, pour donner les dimères naturels. L’obtention, pour la première fois, des dimères avec la bonne configuration en C(16 ) signifie probablement que cette réaction mime bien leur biosynthèse. La réaction de Polonovski modifiée (action de l’anhydride trifluoroacétique sur un N-oxyde) représente un excellent modèle chimique d’une réaction biologique générale des amines tertiaires ou de leurs N-oxydes; on peut donc la considérer comme une réaction biomimétique. De nombreux autres exemples dans la chimie des alcaloïdes démontrent ce fait.La morphine , extraite du pavot, est connue depuis le XIXe siècle; sa structure a été déterminée en 1925 et la première synthèse totale a été finalement réussie en 1952. Ce n’est qu’en 1957 qu’une hypothèse a été faite pour expliquer sa biosynthèse à partir de radicaux phénoliques dérivés de la (face=F0019 size=1梁)N-éthoxycarbonyl-norréticuline, dont le couplage permet de créer la liaison carbone-carbone nécessaire à l’élaboration du précurseur immédiat de la morphine (fig. 7).Une synthèse biomimétique rentable de la morphine n’a été réalisée qu’en 1975. Pour cela il était nécessaire, comme le fait la nature, de créer sélectivement, à partir de la (face=F0019 size=1梁)N-éthoxycarbonyl-norréticuline, les radicaux en position ortho- et para- des fonctions phénols. Ce n’est qu’après de longues recherches que le réactif approprié, le tristrifluoroacétate de thallium (TTFA) a pu être trouvé. Le traitement de la ( size=1梁)N-éthoxycarbonyl-norréticuline par un équivalent de TTFA, dans le chlorure de méthylène à 漣 78 0C conduit, selon une réaction biomimétique, à un dérivé qui peut être ensuite transformé en morphine par des réactions classiques (fig. 7). Cet exemple montre qu’il est quelquefois difficile de trouver le réactif chimique équivalent du système enzymatique.La vincamine , alcaloïde indolique extrait de la petite pervenche, est largement utilisée en thérapeutique pour les troubles de la circulation cérébrale liés à la sénescence. L’insuffisance de l’approvisionnement à partir des sources naturelles a conduit à la mise au point d’une synthèse partielle biomimétique à partir d’un autre alcaloïde plus abondant, la tabersonine (fig. 8). La tabersonine et la vincamine appartiennent au même type biogénétique, la tabersonine étant un intermédiaire en amont de la vincamine dans la suite de la biosynthèse. L’avantage de cette hémisynthèse, à haut rendement, est de faire appel à une matière première naturelle de même configuration absolue, ce qui élimine le problème de la séparation des isomères optiques, nécessaire dans la synthèse classique.Ainsi, les synthèses biomimétiques sont choisies pour l’intérêt qu’elles présentent, en particulier pour la préparation de produits biologiquement actifs.Le plus souvent, les premières synthèses avaient été réalisées de manière classique, soit parce que la biosynthèse n’était pas encore connue, soit parce que la synthèse biomimétique présentait certaines difficultés pour la préparation de l’intermédiaire clé ou pour la recherche du bon réactif.Si seules quelques synthèses biomimétiques sont utilisées industriellement, on observe de nombreux efforts des chimistes organiciens pour réaliser de nouvelles synthèses ou des transformations selon un mode biomimétique, dans le but d’aboutir à des procédés plus simples, donc plus économiques.
Encyclopédie Universelle. 2012.
